Molekyylisidos muodostuu kahden epämetallin välille. Molekyylisidoksen toinen nimi on kovalenttinen sidos. Molekyylisidoksessa atomit ottavat elektroneja yhteiseen käyttöön.
Vesimolekyylissä (H2O) on liittynyt yhteen kaksi vetyatomia ja yksi happiatomi. Happiatomilla on kuusi ulkoelektronia ja vetyatomilla on yksi elektroni. Merkitään ulkoelektronit alkuaineen kemiallisen merkin ympärille.
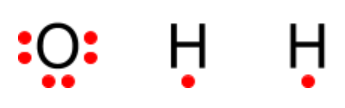
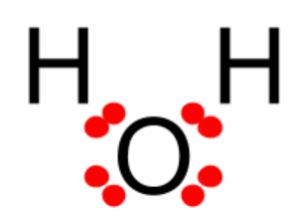
Happi tarvitsee kaksi elektronia lisää, että se saa oktetin (8 ulkoelektronia). Vetyatomi tarvitsee yhden elektronin, että se saa pikkuoktetin (kaksi elektronia ainoalla elektronikuorella). Kun vety ja happi ottavat elektroneja yhteiseen käyttöön, molemmat saavuttavat oktettitilan.
Molekyylit voidaan piirtää helpommin rakennekaavan avulla. Rakennekaavassa viiva tarkoittaa yhtä jaettua elektroniparia. Muita vaihtoehtoja ovat esimerkiksi pallotikkumalli ja kalottimalli.
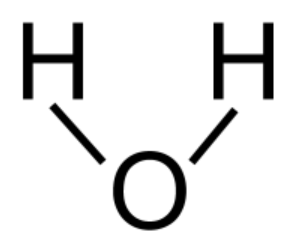 | 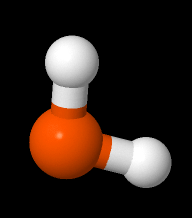 | 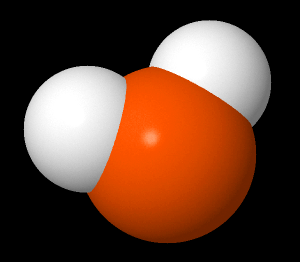 |
| H2O rakennekaava | H2O pallotikkumalli | H2O kalottimalli |
Myös kaksi saman alkuaineen atomia voi liittyä yhteen molekyylisidoksella. Esimerkiksi happimolekyylissä O2 on kaksi happiatomia liittynyt yhteen molekyylisidoksilla. Hapella on kuusi ulkoelektronia, joten se tarvitsee kaksi ulkoelektronia lisää. Kahden happiatomin välille muodostuu kaksoissidos.
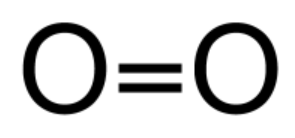 | 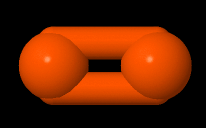 |  |
| O2 rakennekaava | O2 pallotikkumalli | O2 kalottimalli |
Vety, happi ja typpi esiintyvät luonnossa kaksiatomisina molekyyleinä:
- Vetyatomien välillä on yksinkertainen kovalenttinen sidos.
- Happiatomien välillä on kaksoissidos, koska happiatomilla on 6 ulkoelektronia.
- Typpiatomien välillä on kolmoissidos, koska typpiatomilla on 5 ulkoelektronia ja se tarvitsee 3 elektronia lisää saavuttaakseen oktetin.
| Vetymolekyyli H2 | Happimolekyyli O2 | Typpimolekyyli N2 |
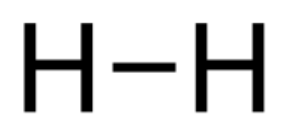 | 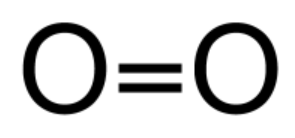 | 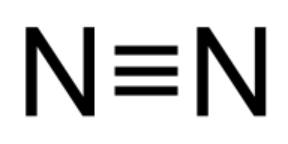 |
 |  |  |
 |  |  |
Valitse oikea vaihtoehto.